ORBITAL
DAN PERANANNYA DALAM IKATAN KOVALEN
A.
SIFAT GELOMBANG
Pada
tahun 1923, Louis de Broglie, seorang mahasiswa Perancis tingkat pasca sarjana,
ia mengungkapkan pendapat yang merevolusioner bahwa electron mempunyai sifat
gelombang dan juga sifat partikel. Pendapat Louis de Broglie kurang dapat
diterima, tetapi pendapatnya kini tumbuh menjadi konsep mekanika kuantum
mengenai gerak electron dan teori orbital molekul.
Heisenberg
menyatakan bahwa pendekatan apapun yang
digunakan untuk menentukan secara bersama-sama posisi dan momentum suatu
objek yang sedang bergerak tidak dapat diukur secara tepat, sebab objek yang
bergerak menimbulkan perubahan dalam posisi dan momentum setiap saat. Prinsip
ini dikenal dengan ketidakpastian Heisenberg, yang menyatakan bahwa posisi dan
momentum suatu materi tidak dapat diukur secara tepat pada waktu bersamaan.
Jika
momentum atau kecepatan suatu partikel dapat diukur secara tepat, maka
posisinya tidak dapat diketahui secara pasti, sebaliknya, jika posisi partikel
dapat diukur secara tepat maka momentumnya tidak dapat diketahui secara pasti,
yang paling mungkin dinyatakan hanya kebolehjadian menentukan posisi dan momentum
dari suatu partikel yang bergerak.
Pada
tahun 1926, Schrodinger mengajukan suatu penemuan gerak electron dalam atom
yang mempunyai sifat gelombang dan sifat partikel dalam tiga sistem koordinat
cartesius. Dasar pemikirannya, jika electron sebagai suatu partikel memiliki
sifat gelombang dalam gerakannya, maka persamaan gerak electron dalam
mengelilingi inti harus terkait fungsi gelombang.
Gelombang
diam yang sederhana, yaitu jenis gelombang yang dihasilkan bila orang memetik
senar, seperti senar gitar, yang kedua ujungnya mati. Jenis gelombang ini
menunjukkan gerak hanya dalam satu dimensi. Sebaliknya gelombang diam yang
disebabkan oleh pemukulan kepala drum adalah berdimensi dua, dan sistem
gelombang electron adalah berdimensi tiga, tinggi gelombang diam adalah
amplitudonya, yang dapat mengarah keatas (nilai positif) atau mengarah kebawah
(nilai negative) terhadap kedudukan istirahat dari senar. Kedudukan pada gelombang yang amplitudonya nol disebut
simpul, dan sesuai kedudukan pada senar gitar yang tak bergerak bila senar
bergetar.
Dalam
hal ini, dua gelombang diam dapat sefase atau keluar fase yang satu terhadap
yang lain. Keadaan antara dalam mana gelombang hanya sebagian sefase juga
mungkin. Istilah ini dapat digambarkan oleh sistem dua gelombang pada dua senar
identik yang bergetar. Jika amplitude positif dan negative dari dua gelombang
saling sesuai, maka kedua gelombang tersebut dapat dikatakan sefase. Namun,
jiak tanda matematik dari amplitudo saling berlawanan, maka gelombang keluar
fase.
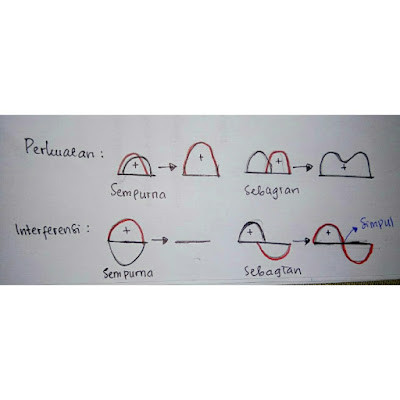
Jika
dua gelombang yang sefase pada senar yang sama saling tumpang tindih, maka
keduanya saling memperkuat. Perkuatan dinyatakan oleh penambahan fungsi
matematik yang sama tandanya yang menggambarkan gelombang. Demikian pula
sebaliknya, sepasang gelombang yang tumpang tindih yang keuar fase, saling
mengganggu atau berinterferensi. Proses interferensi dinyatakan oleh penambahan
dua fungsi matematik yang berlawanan tanda. Interferensi sempurna menghasilkan
penghapusan oleh yang lain. Tumpang tindih sebagian dari dua gelombang yang
keluar fase menghasilkan simpul.
gambar:perkuatan dan interferensi gelombang
Bila
orbital mempunyai amplitude positif dan negative, maka orbital mempunyai
simpul.menggambarkan orbital 1s, 2s, dan 2p, mencakup tanda dari amplitude dan
simpulnya.
Dalam
hal ini, satu orbital atom dapat bertumpang tindih dengan orbital atom dari
atom lain, secara matematik, fungsi gelombang yang menggambarkan setiap orbital
yang tumpang tindih di jumlahkan bersama. Perhitungan ini dikenal sebagai
“kombinasi linear dari orbital atom”, atu teori (LCAO). Jika, orbital yang
bertumpang tindih sefase, maka hasilnya adalah perkuatan dan suatu “orbital
molekul ikatan”. Dilain pihak, interaksi antara orbital atom yang keluar fase menghasilkan
interferensi, yang menimbulkan simpul antara dua inti. Interferensi ini menuju
ke “orbital molekul anti-ikatan”.
1. Ikatan
sigma (σ)
Ikatan
sigma (σ) yaitu ikatan kovalen yang terbentuk akibat tumpang tindih
orbital-orbital ujung ke ujung, dengan kerapatan electron yang terkonsentrasi
diantara inti atom yang berikatan. Di dalam ilmu kimia, ikatan sigma (σ)
merupakan sejenis ikatan kimia kovalen yang paling kuat.
Ikatan
dalam H2 hanya satu dari sekian banyak ikatan sigma yang dijumpai.
Ikatan sigma dapat dijelaskan dengan jelas untuk molekul diatomic menggunakan
konsep grup simetri. Ikatan sikma adalah simetri terhadap rotasi di sumbu ikat.
Berdasarkan definisi tersebut ikatan sigma yang umum adalah s+s, pz+pz,
s+pz, dan dz2+ dz2.
Teori kuantum juga mengatakan bahwa orbital molekulyang bersimetri sama akan
bercampur.
2. Ikatan
pi (π)
Ikatan
pi (π) adalah ikatan kimia kovalen yang dua cuping orbital atam yang
berelektron tunggal bertumpang tindih dengan dua cuping orbital atom lainnya
yang juga berelektron tunggal. Hanya terdapat satu bidang simpul dari orbital
yang melewati dua inti atom. Ikatan pi (π)
biasanya lebih lemah dari ikatan sigma karena rapatan electronnya lebih
jauh dari inti atom yang bermuatan positif, sehingga memerlukan lebih banyak energy.
Jika, dilihat dari sudut pandang mekanika kuantum, kelemahan ikatan ini dijelaskan
oleh ketumpang tindihan yang sangat sedikit diantara orbital p oleh karenanya
orientasinya yang parallel.
A.
ORBITAL IKATAN DAN ANTI-IKATAN
Jika
ada sepasang gelombang saling tumpang tindih, maka sepasang gelombang tersebut
dapat saling memperkuat atau saling berinterferensi. Adanya penambahan dari dua
orbital atom 1s dari dua atom H yang sefase akan menghasilkan orbital molekul
ikatan sigma dengan rapatan electron yang tinggi antara inti yang diberikan.
Bila
keadaan dimana dua gelombang berlawanan fase, maka kedua gelombang tersebut
saling mengganggu, interferensi dari dua
orbital atom yang keluar fase dari dua atom hydrogen memberikan orbital molekul
dengan simpul antara inti. Dalam
orbital molekul ini menentukan, keboleh jadian menentukan electron antara inti
sangat rendah. Karena itu, orbital molekul khas ini menimbulkan sistem dimana
inti tak dilindungi oleh sepasang electron, dan intinya pun saling
toolak-menolak. Karena tolakan inti sistem ini energinya lebih tinggi dari pada
sistem dua atom H yang mandiri. Orbital yang lebih tinggi ini disebut orbital anti-ikatan.
Energy
molekul H2 dengan dua electron dalam orbital ikatan sigma adalah
lebih rendah yaitu 104kkal/mol dari pada energy gabungan dari dua atomhidrogen
yang terpisah. Energy molekul hydrogen dengan electron dalam orbital
anti-ikatan 0*, sebaliknya, lebih
tinggi daripada energy dua atom hydrogen yang terpisah. Energy relative ini
dapat dinyatakan menurut diagaram berikut:
Orbital
molekul, seperti orbital atom, dapat memegang nol electron, yaitu satu electron
electron atu dua electron yang berpasangan , kedua electron dalam molekul
hydrogen berpindah ke orbital berenergi terendah yang tersedia, yaitu orbital
ikatan sigma. Dalam diagram berikut ini, digunakan sepasang panah (satu
mengarah keatas dan satu mengarah ke bawah ) untuk menggambarkan sepasang electron
dengan spin yang berlawanan.
Pada
dasarnya, semua orbital molekul ikatan mempunyai orbital anti-ikatan yang
berhubungan dengannya. Molekul dengan electrode dalam orbital molekul ikatan
mempunyai energy yang lebih rendah dari
pada energy atom non-ikatan, dan molekul dengan electron dalam orbital
anti-ikatan mempunyai energy yang lebih tinggi dari pada atom non-ikatan. Suatu
molekul dikatan dalam keadaan bereksitasi
apabila satu atau lebih electron tidak ada dalam orbital energy terendah.
Berikut ini disimpulkan beberapa
aturan umum yang dapat diterapkan terhadap semua orbital molekul, dan tidak
hanya terhadap orbital molekul H2, diantaranya adalah:
a. Setiap
orbital (molekul atau atom) dapat memegang maksimum dua dua electron yang harus
mempunyai spin yang berlawanan
b. Jumlah
orbital molekul sama dengan jumlah orbital atom yang digunakan dalam pembentukannya.
c. Dalam
pengisian orbital molekul dengan electron, orbital berenergi terendah dan diisi
dahulu. Bila duua orbital tergenerasi dari energy yang sama, masing-masing
mendapat satu electron sebelum salah satu orbital terisi penuh.
A.
ORBITAL HIBRIDA KARBON
Ada
empat orbital atom pada tingkat energy kedua yaitu; satu orbital 2s dan tiga
orbital 2p. Namun demikian, karbon tidak menggunakan keempat orbital dalam
keadaan murninya untuk ikatan. Oleh sebab itu, sebagai gantinya, karboon
bercampur (berhibridisasi), yaitu empat orbital atom tingakt kedua menurut
salah satu dari tiga cara untuk ikatan.
1. Hibridisasi
sp3, digunkan apabila kerbon membentuk empat ikatan tunggal
2. Hibridisasi
sp2, digunakan apabila karbon membentuk ikatan rangkap
3. Hibridisasi
sp, digunakan apabila karbon membentuk ikatan ganda tiga atau ikatan rangkap
terkumulasi (dua ikatan rangkap terhadap suatu atom karbon tunggal).
1.Hibridisasi
sp3
Dalam
metana, atom karbon mempunyai empat ikatan kovalen terhadap hydrogen. Setiap ikatan C-H mempunyai panjang ikatan 1,09 amstrong dan energy disosiasi ikatan
104 kkal/mol. Sudut ikatan antara setiap ikatan C-H adalah 109,50.
Keempat
orbital sp3 mempunyai energy sama agak lebih tinggi dari pada energy
orbital 2s, tetapi agak lebih rendah dari pada orbital 2p. masing-masing obital
sp3 mengandung satu electron untuk ikatan.
Diagram
diatas disebut diagram orbital. Setiap kotak dalam diagram menyatakan orbital.
Energy relative dari berbagai orbital ditandai oleh kedudukan vertical dari
kotak dalam diagram. Electron dinyatakan
oleh panah, dan arh dari spin electron dinyatakan oleh arah dari arh panah.
Bila
atom karbon sp3 membentuk ikatan, hal itu dilakukan dengan tumpsng
tindih masing-masing dari empat orbital sp3 (masing-masing dengan
satu electron) dengan orbital dari empat atom lain (masing-masing orbital
mengandung satu electron secara bergantian).
Pada CH4,
empat orbital hibrid sp3 bertumpang tindih dengan
orbital 1s hidrogen, menghasilkan empat ikatan sigma. Empat ikatan ini memiliki panjang dan kuat ikat
yang sama, sehingga sesuai dengan pengamatan.
2.Hibridisasi
sp2
Senyawa karbon atau pun molekul lainnya dapat
dijelaskan seperti yang dijelaskan pada metana. Misalnya etilena (C2H4) yang
memiliki ikatan rangkap dua di antara karbon-karbonnya. Struktur Kekulem
etilena akan tampak seperti:
Karbon akan melakukan hibridisasi sp2 karena
orbitial-orbital hibridanya akan membentuk ikatan sigma dan satu ikatan pi seperti yang disyaratkan untuk ikatan rangkap dua di antara karbon-karbon. Ikatan hidrogen-karbon
memiliki panjang dan kekuatan ikatan yang sama.
membentuk 3
orbital sp2 dengan satu orbital p tersisa. Dalam etilena,
dua atom karbon membentuk sebuah ikatan sigma dengan bertumpang tindih dengan dua
orbital sp2 karbon lainnya dan setiap karbon membentuk dua
ikatan kovalen dengan hydrogen dengan tumpang tindih s-sp2 yang
bersudut 120°. Ikatan pi antara atom karbon tegak lurus dengan bidang molekul dan
dibentuk oleh tumpang tindih 2p-2p (namun, ikatan pi boleh terjadi
maupun tidak).
1. Hibridisasi sp
orbital 2s hanya
bergabung dengan satu orbital-p, menghasil kan dua orbital sp dan
menyisa kan dua orbital p. Ikatan kimia dalam asetilena (etuna) terdiri dari tumpang tindih sp-sp antara
dua atom karbon membentuk ikatan sigma, dan dua ikatan pi tambahan yang dibentuk oleh tumpang tindih p-p.Setiap
karbon juga berikatan dengan hydrogen dengan tumpang tindih s-sp bersudut
180°.
Sumber: Fessenden Ralp J,
Joan S. Fessendden. 2005. Kimia Organik
Jilid 1 Edisi Ketiga. Terjemahan
A.H Pudjaatmaka. Erlangga: Jakarta




















Assalamualaikum anisa , saya ingin bertanya apa maanfat yang dapat di ambil jika kita mengetahui orde ikatan?
BalasHapusIzin bertanaya,Tolong berikan contoh okatan pi, yg mudah di mengerti
BalasHapusTerimakasih
Bisakah anda memberikan contoh struktur lalu ditandai ikatan sigma dan phi nya?
BalasHapussaya ingin bertanya mengapa Molekul dengan electrode dalam orbital molekul ikatan mempunyai energy yang lebih rendah dari pada energy atom non-ikatan ?
BalasHapusmateri yang anda sampaikan sangat bermanfaat, terutama pada bagian gambarnya lebih bagus lagi dijelaskan secara jelas, hingga mudah dimengerti.
BalasHapus