STEREOKIMIA
Pada isomer geometri terdapat pada
senyawa alkena dan senyawa siklik.
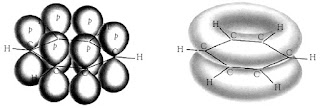
Ikatan rangkap C=C terjadi dari satu ikatan
sigma dan satu ikatan pi. Dengan adanya ikatan pi, maka molekul menjadi terkunci
hanya dalam satu posisi. Dua atom karbon yang berikatan rangkap C=C dan keempat
atom yang terikat pada terletak dalam satu bidang datar dan menempati posisi
yang tetap.
Isomer
geometric, yang diakibatkan oleh ketegaran dalam molekul dan hanya dijumpai
dalam dua kelas senyawa, yaitu: alkena dan senyawa siklik.
Pada dasarnya molekul bukanlah merupakan partikel yang static yang berdiam diri. Mereka bergerak, dan memutar (rotasi) sedemikian sehingga bentuk keseluruhan sebuah molekul selalu berubah berkesinambungan. Akan tetapi, gugus-gugus yang terikat oleh ikatan rangkap tak dapat berputar dengan ikatan rangkap itu sebagai sumbu, tanpa mematahkan ikatan-pi itu. Adapun, energy yang diperlukan untuk mematahkan ikatan-pi karbon-karbon (sekitar 68 kkal/mol) tak tersedia untuk molekul itu pada temperature kamar. Karena, adanya ketegaran ikatan-pi inilah maka gugus-gugus yang terikat pada karbon berikatan pi terletak tetap dalam ruang relative satu sama lain.
Biasanya struktur suatu alkena
ditulis seakan-akan atom-atom karbon sp2 dan atom-atom yang terikat
pada mereka terletak semuanya pada bidang kertas.
Dua gugus yang terletak pada satu
sisi ikatan pi disebut cis (latin, “pada sisi yang sama”). Gugus-gugus yang
terletak pada sisi-sisi yang berlawanan disebut trans. (latin,
“berseberangan”).
Sifat-sifat fisika (seperti titik
didih) cis- dan trans- 1,2-dikloroetena pada dasarnya berbeda. Kedua senyawa
tersebut bukanlah termasuk kedalam isomer-isomer structural karena urutan
ikatan atom-atom dan lokasi ikatan rangkapnya adalah sama. Pasangan isomer ini
masuk dalam kategori umum steroisomer.
Kedua isomer cis-tans mempunyai perbedaan
dalam hal sifat fisiknya, titik didih, titik leleh, atau kelarutan. Dalam
kesetabilan termodinamika isomer trans lebih dari pada isomer cis. Hal ini
disebabkan, karena pada isomer trans posisi L1 dan L2
tidak pada sisi yang sama dan membentuk posisi diagonal/silang, sehingga
ruangnya tidak terlalu berdesakan (crowded), posisi L1=L2 pada isomer cis, yang eterletak pada posisi
yang sama, menyebabkan efek desakan ruang yang cukup besar. Namun, demikian,
isomer trans akan dapat berubah menjadi isomer cis bila ditambahkan energy yang
berupa panas/kalor atau cahaya/foton.
Selain
isomer cis-trans, juga dikenal tatanama isomer geometri dengan menggunakan
awalan E (entgegen) yang setara dengan trans, dan Z (zusammen) yang setara
dengan cis. Kedua awalan tersebut yang berasal dari bahasa Jerman yang artinya berlawanan (entgegen) dan
bersama (zusammmen). Awalan E dan Z digunakkan apabila awalan cis-trans sulit
untuk diterapkan, yaitu bila L1≠L2 dan S1≠S2.
Steroisomer
adalah senyawa berlainan yang mempunyai struktur sama yang berbeda hanya dalam
hal penataan atom-atom dalam ruangan. Isomer geometric juga disebut isomer
cis-trans.
Isomer
cis-trans adalah dimana stereoisomer-stereoisomer yang berbeda dimana
gugus-gugus berada pada satu sisi atau pada sisi-sisi yang berlawanan terhadap
letak ketegaran molekul.
Pernyataan
isomer geometri dalam alkena adalah bahwa setiap atom karbon yang terlibat
dalam ikatan pi mengikat dua gugus yang berlainan, dalam hal ini, misalnya; H
dan Cl atau CH3 dan Cl. Jika salah satu atom karbon berikatan
rangkap itu mempunyai dua gugus identik, misalnya dua atom H atau dua gugus CH3,
maka tak mungkin terjadi isomer geometri .
ketika C=C dilipat 2 kali maka akan terbentuk seperti gambar berikut:
Adolf von Baeyer, seorang ahli kimia Jerman, melontarkan teori bahwa senyawa siklik membentuk cincin-cincin datar. Kecuali pada siklopentana semua senyawa siklik mengalami tarikan (tegang karena tidak leluasa), karena suudut ikatan (bond angel) menyimpang dari sudut tetrahedral 109,5%. Ia menyarankan bahwa, karena suudut cincin luar biasanya kecil, maka dikloropropana dan siklobutana lebih reaktif dari pada alkana rantai terbuka. Menurutnya siklopentana merupakan sistem cincin yang paling stabil (karena sudut ikatan palling dekat dengan sudur tetrahedral), dan rekatifitas meningkat lagi mulai dengan sikloheksana.
Adolf von Baeyer, seorang ahli kimia Jerman, melontarkan teori bahwa senyawa siklik membentuk cincin-cincin datar. Kecuali pada siklopentana semua senyawa siklik mengalami tarikan (tegang karena tidak leluasa), karena suudut ikatan (bond angel) menyimpang dari sudut tetrahedral 109,5%. Ia menyarankan bahwa, karena suudut cincin luar biasanya kecil, maka dikloropropana dan siklobutana lebih reaktif dari pada alkana rantai terbuka. Menurutnya siklopentana merupakan sistem cincin yang paling stabil (karena sudut ikatan palling dekat dengan sudur tetrahedral), dan rekatifitas meningkat lagi mulai dengan sikloheksana.
Perlu
diketahui bahwa suatu cincin datar dengan sudut ikatan 1200,
melainkan suatu cincin yang agak terlipat (puckered) dengan sudut ikatan
mendekati 1090, sudut ikatan sp3 biasa.
Akan tetapi terdapat tarikan cincin
dalam sistem yang lebih kecil. Siklopropana merupakan sikloalkana yang paling
reaktif . kalor pembakaran pergugus metilena lebih tinggi dari pada alkana
lain.
Teori saat ini akan mengatakan bahwa
orbital sp3 atom-atom karbon dalam siklopropana tak dapat tumpang
tindih lengkap satu sama lain, karena sudut antara atom—atom karbon
siklopropana secara geometris harus 600. Ikatan-iakatan sigma cincin
siklopropana berenergi lebih tinggi dari pada ikatan-ikatan sigma sp3
yang mempunyai sudut ikatan normal. Ikatan-ikatan siklopropana lebih mudah
putus dari pada milik ikatan sigma C-C lainnya, serta dalam reaksi-reaksi yang
sepadan, dibebaskan lebih bnayak energy.
Perlu diketahui juga bahwa
siklobutana tak sereaktif siklopropana, tetapi lebih reaktif dari pada
siklopentana jika tunduk padda teori Baeyer, cincin siklopentana stabil dan jauh kalah reaktif dibandingkan dengan
cincin –tiga dan –empat anggauta.
Perkiraan Baeyer meleset untuk
sikloheksana dan cincin-cincin yang lebih besar. Siklohesana dan cincin-cincin
yanglebih besar dari pada sikloheksana memiliki konformasi terlipat dan bukan
sebagai cincin rata, serta tidak sangat reaktif. Cincin-cincin besar biasanya
tidak dijumpai dalam senyawa alamiah, sepepri cincin lima dan enam anggauta.
Baeyer mengiira bahwa kelangkaan ini disebabkan oleh tarikan cincin .
B. KONFORMASI DAN KIRALITAS SENYAWA RANTAI
TERBUKA
Dalam
senyawa rantai terbuka, gugus-gugus yang terikat oleh ikatan sigma dapat
berotasi mengelilingi ikatan itu. Sehingga, atom-atom dalam suatu molekul
rantai terbuka dapat memiliki tak terhingga banyak posisi di dalam ruang relative satu terhadap yang lain. Misalnya,
pada etana mempunyai sebuah molekul kecil, akan tetapi etana dapat memiliki
panataan dalam ruang secara berlain-lainan, inilah yang disebut dengan istilah
konformasi. Konformasi yaitu setiap tatana tiga dimensi atom-atom yang
dihasilkan oleh rotasi oleh sumbu ikatan tunnggal.
Misalnya;
molekul etana yang digambarkan dengan proyeksi Newman. Yang dimaksudkan dengan
gambar proyeksi Newman disini adalah gambar molekul yang diperoleh dengan craa
memandang molekul tersebut dari arah sumbu ikatan karbon-karbon,
Jika
sedang diamati keenam conformer tersebut ternyata hanya terdapat 2 konformer
yang ekstrem yaitu konformasi goyang (staggered) dan ekslips (eclipsed).
Sehingga
pada konformasi “goyang”, ketiga ikatan C-H pada atom karbon yang berdampingan.
Sedangkan, pada konformasi “eklips”, ketiga ikatan C-H pada atom karbon yang
satu berdekatan dengan tiga ikatan C-H pada atom karbon yang berdampingan.
Misalnya
pada senyawa butane, yang memiliki dua gugus metil yang cukup besar pada atom-H2C-CH2,
sehingga butane memiliki dua macam konfortasi goyang. Konfortasi ini dimana
jarak antara gugus-gugus –CH3
terpisah sejauh mungkin disebut juga dengan conformer anti energinya
paling rendah, sedangkan konformasi goyang lainnya dimana gugus-gugus –CH3
agak berjauhan disebut juga dengan konformasi gauche
















makasih anisa materi tentang ISOMER GEOMETRI DALAM ALKENA DAN SENYAWA SIKLIK
BalasHapussangat membantu dalam penyelasaian tugas akhir
menurut anda mana yang lebi stabil antara ikatan sigma dan pi berdasarkan contoh diatas berikan penjelasan salah saatunya ??
BalasHapusMengapa Ikatan-iakatan sigma cincin siklopropana berenergi lebih tinggi dari pada ikatan-ikatan sigma sp3 yang mempunyai sudut ikatan normal. Jelaskan? Terimakasih
BalasHapusMengapa Ikatan-iakatan sigma cincin siklopropana berenergi lebih tinggi dari pada ikatan-ikatan sigma sp3 yang mempunyai sudut ikatan normal. Jelaskan? Terimakasih
BalasHapus